| ID-S09 錆発生のメカニズムについて |
|
梅雨時は、雨が多く、加工部品の錆トラブルが多くなります。この錆の発生するメカニズムについて説明します。 |
|
錆は金属表面で発生するもので、一般の化学反応とは異なります。 |
|
反応式は |
| 2Fe+3/2O2+H2O=Fe2O3・H2O |
| (モル基準) |
|
112Fe+48O2+18H2O=178Fe2O3・H2O(重量基準) |
| であらわされます。つまり、112gの鉄を錆に変えるのに、48gの酸素と、18gの水が必要であるということです1)。反応速度は、単位面積あたりで表示され、例えばある環境では、炭素鋼の腐食速度は、780(g/m2・y)(=0.09g/m2・h)であるといった表示となります。 |
| 電気化学的に錆発生メカニズムを示すと、図1の通りとなります。この錆が、核となり、いわゆる通気差電池(酸素濃淡電池)作用により、さらに成長して、金属面に損傷を与え進行すると考えられます。(図2) |
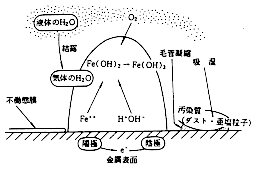 図1 さびの発生と成長メカニズム2) |
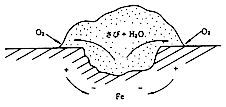 図2 鉄表面に生じたさびによる通気差電池3) |
| したがって防錆処理を施す上では、前処理の際に、この錆核を除去しておかないとムダになることが多いといえます。 |
| 前記の通り、錆が発生し、成長するには液体の水の存在が不可欠ですが、金属表面を包む水膜の厚さと腐食速度は、図3の関係にあるとされています。まずIの領域は、水分が数分子層吸着した状態ですが、不働態膜が10〜40Å程度なので腐食速度は遅いと考えられます。 |
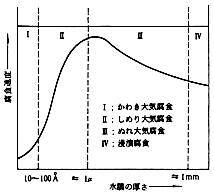
図3 金属表面の水膜厚さと腐食速度4)
| IIの領域では、水分の吸着量が増えて、腐食速度は急激に上昇します。 |
| IIIの領域になると、腐食に必要な酸素の供給が減り、腐食速度は、逆に減少します。水滴が目視ではっきりわかるIVの領域では、水にそのまま浸漬した状態と同じで、さらに減速されます。 |
| 通常大気中におかれた金属表面は、II〜IIIの水膜領域にあり、腐食は、急速に進行しやすいことがわかります。また水膜が亜硫酸ガスや汚染質を含んでいる場合さらに加速されます。 |
| 大気中における腐食速度は、気象変化と密接な関係を持っているが、陸防研の研究では、次の回帰式が提案されています。 |
| A〔mm/y〕 | =0.019+0.0041(気温) |
| −0.00034(湿度) | |
| −0.00015(降水量) | |
| +0.0135(海塩粒子濃度) | |
| +0.0228(亜硫酸ガス濃度) | |
| A:腐食速度〔mm/y〕 湿度:平均湿度〔%〕 気温:平均気温〔℃〕 降水量:平均降水量〔ppm〕 海塩粒子濃度:平均海塩粒子濃度〔ppm〕 亜硫酸ガス濃度:平均亜硫酸ガス濃度〔mdd〕 | |
| 「参考文献」 | |
| 1) | (財)日本産業技術振興協会発行:防錆技術に関するテクノロジーアセスメント(1979、P8〜14) |
| 2) | 朝野秀次郎 防錆管理1 ’79−6 p20 |
| 3) | H. H. ユーリック著 腐食反応とその制御、(1980)p9〜20 |
| 4) | N. D. TOMASHOV;Theory of Corrosion and Protection of Metals,(1966)Macmillan Co.New York |
| 5) | 久松敬弘;日本舶用機関学会誌12、252〜254、442〜448、718〜725(1977) |
|
「出典」 防錆剤Q&A 月刊トライボロジ1990.8 p36−37 | |
Copyright 1999-2003 Japan Lubricating Oil Society. All Rights Reserved.